酸化 マンガン に 濃 塩酸
犬 角膜 ジストロフィー 治っ たなぜ酸化マンガン(Ⅳ)MnO2と塩酸HClが反応すると塩素Cl2 . 
腕 の 筋肉 名称順番に見ていきましょう。 まず、図の左に丸底フラスコがありますね。 この中で、濃塩酸と酸化マンガン(Ⅳ) が反応しています。 これによって、塩素が発生します。. 酸化マンガンと濃塩酸による、塩素の生成での質問 - 教えて!goo. 酸化マンガンと濃塩酸による、塩素の生成での質問. 質問を化学反応式で表しますと、 MnO2 + 4HCl ― → MnCl2 +2H2O + Cl2↑. なんですが、左辺のMn …. 化学I 基礎理解 - 新興出版社啓林館. 酸化マンガン (IV)に濃塩酸を加えて加熱すると塩素が発生する。. この変化を化学反応式で記せ。. 次の場合に起こる変化を化学反応式で記せ。. (1) 加熱した銅線を塩素中に …. 塩化マンガン(II) - Wikipedia. 酸化マンガン (IV) と濃塩酸を混合して加熱することによっても生成する。 この反応はかつて 塩素 の製造法として使われたこともあった。 4価のマンガン塩が塩酸によっ …. 二酸化マンガン - Wikipedia. 二酸化マンガンは、 塩素 の発見にも役立った。 1774年 、 スウェーデン の化学者 シェーレ が濃 塩酸 中に二酸化マンガンを加えると、塩素が発生することを見出した …. 塩素の実験室的製法なぜ加熱するの?酸化マンガンに濃塩酸を . 塩素発生実験において、二酸化マンガンと濃塩酸を加熱する理由は 1 生成する塩素を揮発させて追い出すため。 2 生成するCl2の方がMnO2よりも酸化力が …. 酸化マンガンと濃塩酸による、塩素の生成での質問| OKWAVE. 酸化マンガンと濃塩酸による、塩素の生成での質問 質問を化学反応式で表しますと、 MnO2 + 4HCl ― → MnCl2 +2H2O + Cl2↑ なんですが、左辺のMn …. 酸化還元反応の酸性条件と中性・塩基性条件で何が変わる . その典型的なものとして. 過酸化水素 H 2 O 2. 過マンガン酸カリウム KMnO 4. があります.. この記事では. 酸性条件と中性・塩基性条件で半反応式が変わ …. マンガン酸化物の構造と諸性質 - J-STAGE. にはMn(NO3)2結晶を150 以上の温度で熱すれば よい.150。C以下だと酸化が不十分でMn203が残る・そ の他再現性は確実でないが湿式法でも造られ …. 酸化マンガンと濃塩酸の反応で塩酸と水の除去にそれぞれに . 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱する。 MnO2 +4HCl →Cl2+ MnCl2+ 2H2O 塩素の実験的製法。 酸化還元反応であり、 酸化剤は 酸性条 …. 気体の製法(反応式・原理・注意事項など) | 化学のグルメ. 代表的な中性気体の製法を紹介する。 一酸化炭素CO. 【脱水】ギ酸HCOOHに濃硫酸を加えて加熱する. [ mathrm {HCOOH → CO↑ + H_ {2}O} ] 濃硫 …. 【高校化学】塩素の実験的製法を徹底解説!水と濃硫酸を逆に . 酸化 マンガン が入ったフラスコに、 水、 濃硫酸 の順番でそれぞれが 入っている集気瓶がつながっています。 この順番がとても大切 です。 それぞれ細 …. 外用殺菌消毒剤 アルキルジアミノエチルグリシン塩酸塩製剤. キオーラ の 追随 者
access 型 が 一致 しま せん販売名. ハイジール消毒用液10%. 
ドラクエ 9 て っ こう せき塩素の発生についての質問です。濃塩酸と酸化マンガン(Ⅳ . 酸化マンガンに濃塩酸を加えて加熱し、塩素を発生させますが、なぜ加熱させるのですか? 高校の教科書には詳しく書いてなかったのですが、参考書に はこうありました。 "本来、酸化力は塩素の方が酸化マンガンより少し強く、常温では平衡. 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱すると、塩化 . 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱すると、塩化マンガン(Ⅱ)と水素と塩素ができます。36,5%の濃塩酸100mLから発生する塩素の体積(標準状態)を求めてください。濃塩酸の密度を1,20g/mL とします。 詳しい解説を 補足 . 化学I 基礎理解 - 新興出版社啓林館. 酸化マンガン(IV)に濃塩酸を加えて加熱すると塩素が発生する。この変化を化学反応式で記せ。 (4) 次の場合に起こる変化を化学反応式で記せ。 (1) 加熱した銅線を塩素中に入れる。 (2) 塩素を水に溶かす。 1 2 (5) 室温で水と激しく反応し . 酸化マンガン(Ⅳ)と濃塩酸の反応MnO2+4HCl→MnCl. - Yahoo . 酸化マンガン(Ⅳ)と濃塩酸の反応MnO2+4HCl→MnCl2+2HCl+Cl2がどうしてこうなるのか教えてください。 ta_yudaiさん酸化マンガン(Ⅳ)に濃塩酸を加えて加熱する。MnO2+4HCl→Cl2↑+MnCl2+2H2O*塩素の実験的製法。酸化還元反応であり、酸化剤は酸性条件下のMnO2でその半反応式はMnO2+4H++2e …. 酸化マンガン(IV)に濃硫酸を加えて加熱した時の化学反応式は . 化学で 酸化マンガン(Ⅳ)と濃塩酸とを反応させて塩素を発生させる という式の作り方がわかりません。 半反応式から作るんだとは思っているんですが、よくわからないです。 できれば丁寧に教えてください。. 塩酸に二酸化マンガンを加えると塩素が発生する化学反応式な . 塩素発生実験において、二酸化マンガンと濃塩酸を加熱する理由は 1 生成する塩素を揮発させて追い出すため。 2 生成するCl2の方がMnO2よりも酸化力が強いのでこの反応は吸熱過程であるから、加熱しないと進行しないから と習いました. 酸化マンガン(4)に濃塩酸を加えて加熱すると、黄緑色気体が . 酸化マンガン(4)に濃塩酸を加えて加熱すると、黄緑色気体が発生した。 この反応で、塩素原子の酸化数が-1→0のなっているのですが、理解できません。考え方を教えてください。お願いいたします。 発生した気体が塩素Cl2であることは分かってます?高校化学で、黄緑のガスといったらCl2です . 酸化マンガン (IV)に濃塩酸を加えて加熱 - MnO2+4HCl→Mn . 酸化マンガン(IV)に濃塩酸を加えて加熱 MnO2+4HCl→MnCl2+2H2O+Cl2このマンガンの酸化数は4→2になっているのでしょうか?IVというのが酸化数4を表してるってことですか? ・「IVというのが酸化数4を表してるってことですか?」そうです。酸化マンガンにはMnO、Mn₂O₃、MnO₂、Mn₂O₇ …. 塩素発生実験において、二酸化マンガンと濃塩酸を加熱する . 1 回答. 塩素発生実験において、二酸化マンガンと濃塩酸を加熱する理由は 1 生成する塩素を揮発させて追い出すため。. 2 生成するCl2の方がMnO2よりも酸化力が強いのでこの反応は吸熱過程であるから、加熱しないと進行しないから と習いました。. ここで . 塩素の製法についての質問です(>_<)はじめに濃塩酸と酸化 . Q1:はじめに濃塩酸と酸化マンガン(Ⅳ)とで反応させますが生成された塩化マンガン(Ⅱ)はどこにいくのでしょうか? A1:濃塩酸と酸化マンガン(Ⅳ)を反応させた丸底フラスコ内にとどまります。 Q2:酸化マンガン(Ⅳ)と濃塩酸との反応では塩化水素ができないのになぜ塩化水素が出てきて . 【高校無機化学】熱分解反応のポイント | TEKIBO. おかだ いら ゴルフ リンクス 攻略
ニシン の 山椒 漬け 食べ 方濃塩酸と酸化マンガン(Ⅳ)から塩素を発生させる反応 濃塩酸 HCl と酸化マンガン(Ⅳ) MnO₂ 混ぜ加熱することで、塩素Cl₂を発生させることができます。 これは、 酸化還元反応 を利用した気体の発生方法です。 ハロゲン化物 . 無機化学のまとめと効率的暗記|化学反応式のまとめ | 耳たこ . 07 酸化マンガン(Ⅳ)と濃塩酸で加熱 問題07 酸化 さんか マンガン(Ⅳ)に 濃塩酸 のうえんさん を 加 くわ えて 加熱 かねつ する。 [ 解答と解説を見る ] 反応式 塩素 えんそ の 実験室的製法 じっけんしつてきせいほう。 MnO₂ + 4HCl → を水 . 高校化学の問題です。塩酸と過マンガン酸カリウムとの化学 . 1、 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱した。 この実験を化学反応式で表せ。 2、 ヨウ化カリウム水溶液に臭素水を加えた場合の反応を、化学反応式で表せ。 化学 人気の質問 化学です。 硫酸酸性の過マンガン酸カリウム水溶液に . 酸化マンガン(ⅳ)に濃塩酸を加えて加熱すると塩素が発生 . 酸化マンガン(ⅳ)に濃塩酸を加えて加熱すると塩素が発生する反応が、酸化還元反応になるわけを教えてください。 Mnは酸性溶液では2価が安定ですので(これがポイント)、4価の二酸化マンガンMnO2は酸化剤として以下のような反応式で2価のマンガンイオンになります。MnO2+4H++2e-→Mn2++2H2O . 酸化マンガン(IV)に濃塩酸を加えて加熱すると気体が発生する . 反応式は、MnO₂+4HCl→MnCl₂+Cl₂+2H₂O Mnの酸化数が+4→+2に減少しているので還元、逆に塩酸のClがCl₂と なって酸化数が-1→0に増加しているので酸化している。 よって、酸化還元反応である。 反応式で表すことができれば、その反応が酸化還元反応かどうか わかります。. たいらや 牛久 チラシ
車検 の 速 太郎 広陵 大塚 店化学 塩素の製法 -化学塩素の製法「酸化マンガン(IV)に濃 . 化学塩素の製法「酸化マンガン(IV)に濃塩酸を加えて過熱する。」酸化剤 : MnO2 + 4H+ + 2e- → Mn2+ + 2H2O ・・・1還元剤 : 2Cl- → Cl2 + 2e- ・・・2目的の式はMnO2 + 4HCl → MnCl2 + 2H2O + Cl2ですが1と2を足すとMnO2 . 酸化マンガンと濃塩酸による、塩素の生成での質問| OKWAVE. 酸化マンガンと濃塩酸による、塩素の生成での質問 質問を化学反応式で表しますと、 MnO2 + 4HCl ― → MnCl2 +2H2O + Cl2↑ なんですが、左辺のMnは(IV)なのに、右辺のMnはどうして(II)になるんですか? 後、この塩素を下方置換で得るために、 水→濃硫酸→下方置換のビーカー という順に配置し .
頭 の かさぶた酸化マンガン(Ⅳ)はなぜ触媒なのに濃塩酸と反応するのでしょうか? この場合酸化剤として働くと書いてあるのですが、酸化マンガン(Ⅳ)は触媒じゃないのですか? もしよろしければこの場合何を酸化させているのかも教えてくれるととても. 酸化マンガンと濃塩酸を混合し、加熱することによって塩素を . 酸化マンガンと濃塩酸を混合し、加熱することによって塩素を得る製法について質問です。この時に発生する不純物は、水と塩化水素であると参考書にあったのですが、どうして塩化水素が不純物 になるのですか?また、次亜塩素酸は不純物にはならないのですか?この反応の化学式はMnO2+4HCl . 酸化マンガンと濃塩酸から塩素を作る実験についてなのですが . 
突然 手足 を 失っ て 雄太酸化マンガンと濃塩酸による、塩素の生成での質問 - 教えて!goo. 酸化マンガンと濃塩酸による、塩素の生成での質問質問を化学反応式で表しますと、MnO2 + 4HCl ― → MnCl2 +2H2O + Cl2↑なんですが、左辺のMnは(IV)なのに、右辺のMnはどうして(II)になるんですか?後、この塩素を . 塩化マンガン(II) - Wikipedia. 酸化マンガン(IV) と濃塩酸を混合して加熱することによっても生成する。 この反応はかつて 塩素 の製造法として使われたこともあった。 4価のマンガン塩が塩酸によって2価に 還元 され、同時に塩化物イオンはマンガンによって塩素に 酸化 される反応である。. 化学です。この問題の解き方を教えて下さい。Q、酸化マンガン . Q、酸化マンガン(IV)に濃塩酸を加え て加熱すると、塩化マンガン(Ⅱ)と水 と塩素ができる。36.5%の濃塩酸100 mLから発生する塩素の体積(標準 36.5%の濃塩酸100 mLから発生する塩素の体積(標準. 【高校化学】気体の製法、加熱が要るか? | 人気学参『高校 . 塩酸を濃塩酸にし、さらに加熱しているのです。 じゃあ、MnO 2 なんて弱い酸化剤を使わず、 強い酸化剤・過マンガン酸カリウムKMnO 4 水溶液を使えば加熱しなくてよくね ? そうなんです。しかし、問題があります。 塩酸は水溶液、過 . 塩素の捕集方法について。高校 - 塩素って高校科学だと濃塩酸 . 塩素の捕集方法について。高校 塩素って高校科学だと濃塩酸と酸化マンガンⅣを加熱して作りますが、捕集方法は下方置換と書いてあります。なぜ水上置換ではダメなのでしょうか。 水と反応しにくい気体は水上置換で捕集するのはわかりますし、塩素が水に溶けて塩酸と次亜塩素酸を作って . 二酸化マンガン - Wikipedia. 現代でも同じ用途に二酸化マンガンを用いている。 二酸化マンガンは、塩素の発見にも役立った。1774年、スウェーデンの化学者シェーレが濃塩酸中に二酸化マンガンを加えると、塩素が発生することを見出した。. 化学です 酸化マンガンと濃塩酸との反応で生じる 塩化マンガン . MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑. 1. 件. 化学です酸化マンガンと濃塩酸との反応で生じる塩化マンガンはどーなるのですかどこにも取り上げられていないので知りたいですそもそもその反応は四価の二酸化マンガンと塩化水素の反応ですから、塩化水素が塩素へ . 二酸化マンガン - Wikipedia. 現代でも同じ用途に二酸化マンガンを用いている。 二酸化マンガンは、塩素の発見にも役立った。1774年、スウェーデンの化学者シェーレが濃塩酸中に二酸化マンガンを加えると、塩素が発生することを見出した。. 化学酸化還元反応式についてです。 - 問題)酸化マンガンIVに濃 . 問題)酸化マンガンIVに濃塩酸を加え加熱 酸化マンガンIVが今回の酸化剤のため半反応式を書くと、、 「MnO2+4H*+5e-→Mn²*+4H2O」とこの式は当然分かります。 すると濃塩酸のほうが逆に還元剤であることも当然理解ができいざ半反応式. 量的関係です。 - 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱 . 酸化還元反応の化学式の作り方で足りないイオンを補う操作があると思うのですが、左辺と右辺で全く同じ量のイオンを出すのですか?? (硫酸酸性下過マンガン酸カリウムと過酸化水素は最後にK2SO4を出してるのは両辺同じ量のイオンを. 反応式・化学 - 「酸化マンガン(Ⅳ)に濃塩酸を加えて熱する . 反応式・化学 「酸化マンガン(Ⅳ)に濃塩酸を加えて熱すると、黄緑色気体が発生した。この反応式を書け」という問題の答えが「MnO2+4HCl→MnCl2+2H2O+H2」なのですが、なぜこの形になったのかがわかりません。どなたか、解説を教えてください。 高校だと半反応式を書いて数合わせをして . 高校化学 ハロゲン - Wikibooks. 実験室的:酸化マンガン(IV)に濃塩酸を加え、加熱する。 + + + なお、この反応では塩素と同時に水も生成する。さらに、濃塩酸には次節に見るように揮発性がある。したがって、この反応により得られる気体は純粋な塩素ではなく、水 . 化学反応式について。酸化マンガン(ⅠⅤ)と濃塩酸を加熱すると . 濃塩酸を加えているという時点で水溶液中には酸である塩化水素が 沢山存在しています。 そのため、ryoko08181214さんの考えた反応によって 水酸化マンガン(Ⅱ)が生成したとしても溶液中に沢山ある 塩化水素と中和反応をするためMnCl₂が生成することになります。. 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱した時の反応式について . 1 回答. 酸化マンガン (Ⅳ)に濃塩酸を加えて加熱した時の反応式について、塩化物イオンCl-が還元剤、酸化マンガンMnO2が酸化剤となっています。. 濃塩酸の水素イオンが還元剤とならないのはなぜですか?. 化学 ・ 55 閲覧. 革製品 の 汚れ 落とし
無料 で 取れる 資格酸化マンガンと濃塩酸は加熱をして反応させ、酸化マンガンと . 
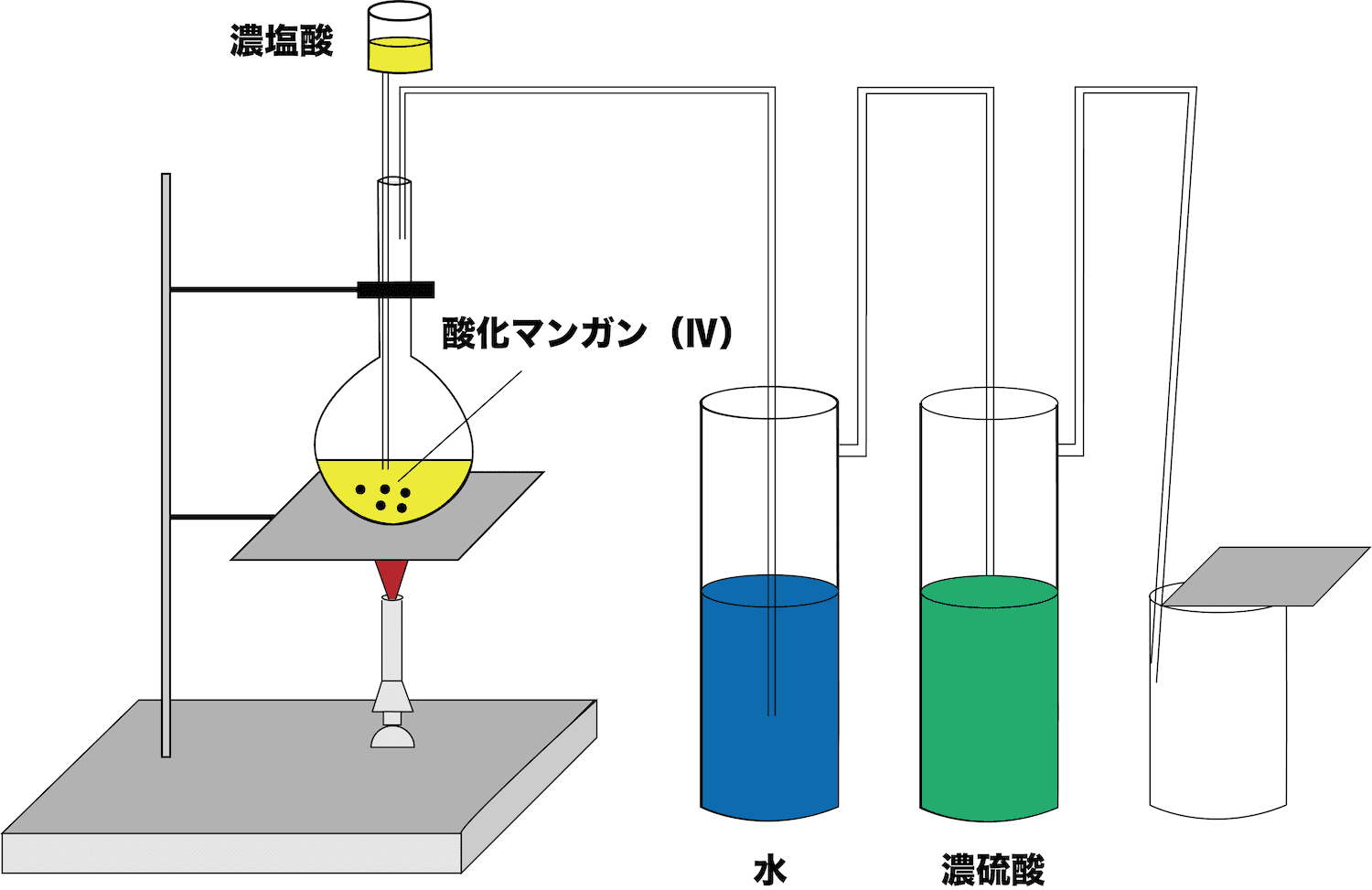

チョコ に 合う ブランデー酸化マンガン(Ⅳ)+濃塩酸による塩素の製法の図では、滴下 . 酸化マンガン(Ⅳ)+濃塩酸による塩素の製法の図では、滴下ろうと、丸底フラスコどちらにも濃塩酸が入っています。 これは、反応の途中を表しているという認識でいいですか?(元々、丸底フラスコには濃塩酸は入っていなくて、滴下ろうとで滴下して図のようになった。ということ)宜しくお . 塩素の製法 -塩素を作るときに 酸化マンガンに濃塩酸をくわえ . 塩素の製法について教えて下さい 塩素を発生させ捕集する問題で、図が書いてあり物質名を選択する問題があります。 精製方法は、 (1)フラスコ内で <酸化マンガン>に<濃塩酸>を加えます。 (2)<水>で 塩素に混じって出てくる塩化水素を吸収します。. 入試で役立つ化学 触媒について - 【公式】マンツーマン指導の . この反応の反応式には酸化マンガン(Ⅳ)は出てきません。 また、塩素を発生させる方法に、 酸化マンガン(Ⅳ)に濃塩酸 を加えて加熱するという方法があります。 この時の酸化マンガン(Ⅳ)は触媒ではありません。 この反応は酸化還元 . 酸化還元. しかし、酸化還元滴定においては、酸化剤の滴定量が変化してしまう邪魔な反応です。また、希硝酸 HNO 3 は、過マンガン酸イオン MnO 4-に酸化されることはありませんが、硝酸イオン NO 3-自身が、次のように酸化剤として作用します。. 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱した。 - Yahoo!知恵袋. 酸化マンガン(Ⅳ)に濃塩酸を加えて加熱した。 この反応で何故酸化還元反応と分かるのかが分かりません。あと酸化剤だとしてもMnO2はMnO2+4H++2e-→Mn2++2H2Oと書いてますが僕が覚えたのはMnO4−→Mn2+です式はこれをいじくって考えたものなんですか? 一番簡単にわかる方法としては、>酸化 . 『酸化マンガン(Ⅳ)に濃塩酸を滴下し、乾燥した塩素を得る時の . 『酸化マンガン(Ⅳ)に濃塩酸を滴下し、乾燥した塩素を得る時の、精製部・捕集部を選べ』と言う内容の問題です。 その際、精製部に下の装置を使用すると言う意味が分かりません。捕集部の解説では、「塩素はかなり水. 高校化学について質問します。塩素を、酸化マンガン(Ⅳ)と . 教科書に載っていたこと 塩素は酸化マンガンに濃塩酸を加えて加熱することで発生する。 4HCl+MnO2→2H2O+Cl2 水は塩化水素を、濃硫酸は水分を取り除くために用いられる。 水分を取り除けなくなるので、濃硫酸と水は逆にしてはいけない. 酸化マンガン(IV)に濃塩酸を加えて加熱する塩素の製法について . 酸化マンガン(IV)に濃塩酸を加えて加熱する塩素の製法についての質問です。 MnO₂+4HCl→MnCl₂+2H₂O+Cl₂ 水によってHClを取り除くとなっていますが、上の反応式でいくとHClとMnO₂が混ざった時点でMnCl₂に変化しますよね。水で . 化学塩素の製法「酸化マンガン(Ⅳ)に濃塩酸を加えて過熱 . 化学塩素の製法「酸化マンガン(Ⅳ)に濃塩酸を加えて過熱する。」酸化剤:MnO2+4H++2e-→Mn2++2H2O・・・1還元剤:2Cl-→Cl2+2e-・・・2 目的の式はMnO2+4HCl→MnCl2+2H2O. Yahoo!知恵袋 カテゴリ Q&A一覧 公式・専門家 . iphone 壁紙 別々
化学反応式一覧(理論化学・無機化学)【大学受験】 | 大学 . 解説授業一覧はこちら→化学反応式の王道の解説動画・授業動画一覧 (1)中和と電離 ①塩酸と水酸化ナトリウム コンテンツ 「大学受験の王道」をご利用いただいているみなさまへお願いがあります。 LINEで質問や相談に答えます!. 化学酸化還元 - 過マンガン酸カリウムを酸性にするとき塩酸や . まず、この場合は塩酸はなるとしたら還元剤です(塩素の酸化数はー1)。 過マンガン酸カリウムに濃塩酸を加えると、塩素が発生します。 塩酸が酸化剤になるのは、例えばマグネシウムと塩酸の反応ですね。 この場合は水素イオンが還元されて、気体の水素が発生します。. 高校化学基礎です以下の問題に反応式も含めて解説して欲しい . 率直な感想ですが、 ダルっ 感想失礼しました笑 ⑸酸化マンガン(Ⅳ)に濃塩酸を加えて加熱 塩素の発生ですね。 酸化マンガン(Ⅳ)が酸化剤として働き、塩化物イオンが還元剤として働きます。 酸化剤の半反応式 MnO₂+4H⁺+2e⁻→Mn²⁺+2H₂O 還元剤の半反応式 2Cl⁻→Cl₂+2e⁻ 左辺,右辺をそれぞれ . 水酸化マンガンMn (OH)_2に濃硝酸を加えたときの化学反応式を . 水酸化マンガンMn(OH)_2に濃硝酸を加えたときの化学反応式を教えてください。お願いします。 順番では、HNO3→H++NO3-Mn(OH)2+2H+→Mn2++2H2Oこの時点でMn2+・倍量のNO3-がイオンとして溶存反応式としては先の解答者の通りですが、水溶液中にMn(NO3)2としては溶けていないですからね.